单位:国家呼吸医学中央 广州医科大学附属第一医院
引用本文: 冯华焯, 魏锋, 王健. 单细胞转录组测序在肺动脉高压的研究进展 [J] . 中华结核和呼吸杂志, 2024, 47(4) : 396-400. DOI: 10.3760/cma.j.cn112147-20240116-00033.

经全国连续医学教诲委员会批准,本刊开设继教专栏,每年从第1期至第10期共刊发12篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费得到Ⅱ类继传授教化分0.5分,整年最多可获5分。
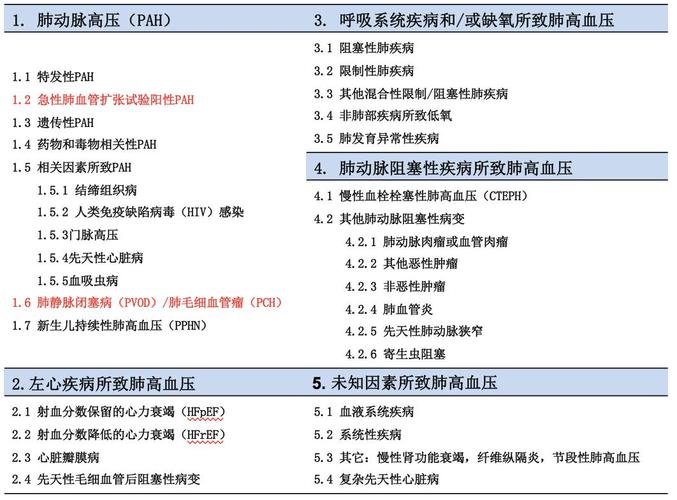
肺动脉高压是一种以肺动脉压力升高、右心室肥厚以及功能障碍为特色的严重肺血管疾病,目前发病机制仍旧不清。此前的研究通过转录组测序等手段识别出干系基因,建立了模型以识别肺动脉高压病例并预测疾病严重程度,而单细胞组学的发展为肺动脉高压的分子机制研究供应了从细胞层面理解疾病的精确方法。单细胞组学剖析有助于揭示不同细胞类型在病变过程中的特异性以及微环境改变对肺动脉构造改变的影响。本文综述了单细胞转录组学在肺动脉高压研究中的进展,磋商其在不同类型的肺动脉高压患者、模式动物研究以及联合基因编辑技能的运用和研究进展,并谈论和展望该技能在疾病机制和临床治疗研究中的潜力。肺动脉高压(pulmonary hypertension,PH)是一种由多种病因导致的、严重的肺血管疾病,其关键特色为肺动脉持续高压,引起肺循环紊乱和肺组织的功能障碍。PH定义为在海拔水平、静息状态下通过右心漂浮导管测得的肺动脉均匀压力达到或超过25 mmHg(1 mmHg=0.133 kPa)的一类肺血管病症[1],包含5类临床亚型:(1)动脉性PH(pulmonary arterial hypertension,PAH);(2)左心疾病干系的PH;(3)肺疾病干系的PH;(4)慢性血栓栓塞性PH(chronic thromboembolic pulmonary hypertension,CTEPH);(5)不明缘故原由导致的PH。环球范围内,PH的发病率估计为每10万人中15~50例,女性的患病率显著高于男性,确诊后均匀生存期约为2.8年[2]。当前针对肺动脉高压的治疗策略涵盖药物治疗、外科手术以及赞助疗法。既往的研究已经阐明离子通道、内皮素受体通路、一氧化氮通路和磷酸二酯酶5通路等参与肺血管的紧缩,而当前的药物靶向疗法旨在通过抑制这些特定的病理路子,从而减轻肺动脉压力和血管阻力[2, 3, 4, 5]。只管临床试验结果具备效用,但疗效不一、耐药性发展、预后改进有限等问题仍旧存在,急迫须要探索新的研究方向和治疗目标[6, 7]。传统的研究常日聚焦于某个或几个的分子或基因,研究成果常日局限于某种表型或征象,无法从更高的高维度去不雅观察、阐明生物学征象。以Illumina为代表的二代测序(next generation sequencing,NGS)技能发展使研究者可以从单次实验中得到成千上万个分子或基因的信息[8]。而环绕中央法则开展的不同类型的组学测序技能(如转录组学、基因组学、蛋白组学、代谢组学、表不雅观遗传组学和微生物组学等)大量运用,结合生物信息学剖析方法,揭示大量未知生物学过程,医学和生物学正式进入“信息时期”[8]。转录组学(RNA sequencing,RNA-seq)利用核苷酸的碱基互补配对事理对RNA进行捕获、测序、计数和注释,并由此推断基因的表达水平[9]。最初的转录组学研究紧张是通过利用微阵列芯片(micro array)和转录组测序(bulk RNA-seq)对某个样品的整体基因表达水平进行评估。然而,这些研究常日只能反响样品整体的转录谱改变。PH发展过程中存在肺血管重塑(内皮细胞凋亡和病理性增殖、平滑肌细胞增殖等)和大量炎症细胞浸润(T细胞、B细胞等)[10, 11, 12],乃至同一基因在不同细胞存在相反的表现[13]。因此,有必要在更精确的单细胞水平上理解PH对细胞亚型的影响。比较于表达芯片和转录组测序[14, 15],单细胞测序技能通过微流控或微孔板技能捕获和标记单个细胞的分子,利用测序技能对单个细胞内的RNA、代谢物、表不雅观遗传学调控等方面的旗子暗记改变进行捕获[16]。单细胞RNA测序(single-cell RNA sequencing,scRNA-seq)是目前运用最广泛的单细胞技能。通过高分辨率的单细胞组学图谱,研究者得以对不同状态下细胞的分布、转录谱改变、细胞通讯、细胞分解等过程进行更深层次的研究。动物模型的是研究疾病发病机制和治疗的关键一环,选择得当的动物模型对付阐明该疾病的发病机制至关主要。目前认为,慢性缺氧(hypoxia,HYP)勾引的PH模型反响了由缺氧成分导致的PH(如肺疾病或高原性PH)的病理改变[17],慢性缺氧联合SU5416(chronic hypoxia combined with SU5416,SuHx)和野百合碱(monocrotaline,MCT)勾引的模型仿照1型PH(如PAH)。然而,现有的动物模型都不能完备再现人类 PH的独特病理改变。例如,只管MCT和SuHx都能诱发严重的PH表型,但是特发性肺动脉高压(idiopathic pulmonary arterial hypertension,IPAH)肺血管特色性的“丛样病变”只能在SuHx模型中不雅观察到;而MCT能诱发更显著的肺血管周围炎症细胞浸润和炎症因子增加[18]。因此许多研究都在谈论这些PH模型的优缺陷及其对人类PH研究的适用性,或者更详细地说,适用于哪一类人类PH[19, 20]。本文将先容近年来揭橥的RNA-seq和scRNA-seq研究,重点谈论单细胞RNA测序技能对PH研究的影响。此外,我们还将综述常用PH动物模型的RNA-seq和scRNA-seq研究,磋商PH动物模型与人类PH的关系,为进一步揭示PH机制和研发新疗法打下坚实根本。高通量组学技能的快速发展使得PH的发病机制被更深层次地解析。在单细胞测序技能涌现以前,研究者利用微阵列芯片和bulk RNA-seq是紧张研究手段[9]。Rhodes等[14]对359例特发性、遗传性和药物诱发的PAH患者和72名康健对照者的全血样本进行转录组测序(RNA sequencing,RNA-seq),识别出与PAH干系的507个基因,并构建出高准确度的PAH病例识别模型,能识别临床预后较差的患者。该研究还提出,PAH的全血RNA特色改变与疾病的严重程度有关,尤其是SMAD5基因变异可能会增加PAH的易感性。Elinoff等[15]网络了7项研究(共156例PH患者和110名康健对照者)的全基因组血液表达谱数据,利用Meta剖析揭示了1 269个差异表达的独特基因转录本,创造滋扰素、rapamycin/p70S6K、应激激酶和Toll样受体旗子暗记转导等通路在PH患者中被特异性激活,该研究揭示了PH患者血液中稳定且普遍的转录组特色,有助于确定生物标志物和治疗靶点。此外,部分研究者把高通量组学运用在PH动物模型中[21, 22, 23, 24]。Xiao等[23]采取RNA-seq技能研究了对照组大鼠和注射MCT大鼠在不同期间的肺组织转录组学变革,创造Toll样受体和Nod样受体通路的激活与损伤干系分子模式(damage-associated molecular pattern,DAMP)的上调有关,而RIPK3介导的坏去世匆匆成了MCT勾引的PH中DAMP的产生。IPAH是1型PH的亚分类,紧张由已知的罕见致病基因变异引起[2],个中大多为骨形态发生蛋白受体Ⅱ(bone morphogenetic protein receptor type Ⅱ,BMPR2)基因突变[25]。病理学和细胞学研究已经揭示了IPAH的发生过程:血管内膜的肺动脉内皮细胞(pulmonary arterial endothelial cells,PAEC)初期凋亡导致内皮樊篱毁坏,舒张功能减退,同时开释细胞因子促进中膜肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMC)增生、紧缩,导致血管重塑与紧缩功能加强[10]。在病变后期,病理性的PAEC增生,导致肺中小动脉堵塞,并形成特色性“丛样病变”。这个过程还伴随肺动脉外膜成纤维细胞增生和肌化和炎症细胞浸润等[11],但是这些细胞参与的IPAH发生的机制仍旧不清楚。Crnkovic等[26]对3例IPAH患者的和3例康健对照的肺动脉组织进行单细胞RNA测序,创造IPAH患者PASMC、T细胞和NK细胞比例增加,而中性粒细胞减少。细胞通讯剖析创造康健对照组的细胞间互换分布均匀且相互联系,而IPAH样本展示了旗子暗记转导的严重扭曲,大部分细胞的相互浸染转向PAEC、PASMC和成纤维细胞等肺动脉构造细胞。作者进一步把PASMC分为紧缩型、氧感应型、合成型和成纤维型等4个亚群。IPAH时PASMC会向合成型和成纤维型两个亚型转变,而紧缩型SMC减少,揭示了肺动脉重塑过程的细胞状态改变。该研究深入揭示了IPAH发病过程中存在PASMC细胞状态的转变过程,为肺动脉高压发病机制供应新的见地。另一项对IPAH患者和对照组的全肺组织的单细胞RNA测序研究创造PASMC和PAEC在IPAH发生时产生显著改变[27]。研究揭示了IPAH时PAEC高表达的基因包括ROBO4、APCDD1、NDST1、MMRN2、NOTCH4和DOCK6等,而这些基因大多还未被研究。此外,一些转录因子在IPAH内皮细胞中上调表达,包括SOX18、STRA13、LYL1和ELK。为了进一步解析PAEC的异质性,Asosingh等[28]通过分离提取IPAH患者肺组织的PAEC,把PAEC分为8个独特的亚群,并表明IPAH患者中存在具有增殖和血管天生特色的PAEC亚群,可能是导致血管重塑的主要病理成分。除了肺动脉及其周围微环境的改变外,肺动脉高压患者的血液细胞也会发生显著改变。Zhang等[29]通过分选IPAH患者外周血中性粒细胞并进行单细胞测序,鉴定了5个不同的亚群,个中一个亚群表现出较高水平的MMP9基因表达,并且这种表达与患者的预后密切干系。IPAH患者的中性粒细胞在表达特定基因和参与特定功能方面存在差异,可能参与了疾病的发生。肺动脉内膜血栓形成是CTEPH独特的病理特色,紧张通过手术治疗。Viswanathan等[30]网络了手术剥离的CTEPH患者的肺动脉内膜组织,通过单细胞RNA测序鉴定细胞类型,创造个中包含巨噬细胞、T细胞和SMC,指出巨噬细胞和T细胞的慢性炎症在CTEPH的发展中起着关键浸染。此外,该研究还创造SMC具有多样性,以及一些特定亚群可能与纤维化干系,揭示了CTEPH病理生理学中的多种细胞类型之间的繁芜相互浸染。该研究还提出蛋白酶激活受体1(protease-activated receptor 1,PAR1)可能是CTEPH潜在的治疗靶点。通过抑制PAR1的表达,可以减少PASMC和肌成纤维细胞的增殖和迁移。作者认为CTEPH可能与动脉粥样硬化具有类似的病理生理过程,慢性炎症通过巨噬细胞和T细胞驱动血管重塑,而PAR1可能是治疗的潜在靶点。另一项单细胞组学研究[31]从5例CTEPH患者的肺动脉内膜切除组织中鉴定出11种细胞类型。轨迹推断剖析显示细胞类型沿着CTEPH的发育轨迹,相互间存在密切通信。配体-受体相互浸染揭示了巨噬细胞与疾病干系细胞类型之间,以及平滑肌细胞与成纤维细胞或内皮细胞之间的通信。这些创造有望为CTEPH的治疗和管理供应新的思路,并且对付理解慢性血栓栓塞性肺动脉高压的发病机制具有主要意义。低氧性PH属于3型肺动脉高压,紧张由高原低氧或肺部疾病低氧所致。Wu等[32]描述了高原性PH患者外周血中的免疫细胞的单细胞转录图谱,揭示了单核细胞具有独特的表型。患者的外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中,C1型(非经范例)和C2型(中间型)单核细胞比例显著增加,而与高原性PH干系的单核细胞亚群的低氧勾引转录因子-1α(hypoxia inducible transcription factor-1α,HIF-1α)表达量显著减少。此外,该研究还网络了非高原性PH患者的外周血免疫细胞的单细胞测序数据,并与高原性PH进行比较。结果显示,11种紧张免疫细胞类型的在两者之间的分布相似,这表明高原性PH和其他类型的PH可能存在类似的免疫适应。作者进一步创造,在单核细胞中,C2型单核细胞在非高原性PH的占比远高于高原性PH。PH动物模型是研究药物和治疗靶点的关键载体。动物模型的疾病状态可能与人类疾病存在差异,多种药物在动物模型中表现精良,然而却无法在PH患者中展现预期治疗效果,限定了研究结果的转化运用[22]。单细胞组学供应了独特的角度揭示 PH 患者与动物模型的差异。Hong 等[33]剖析PH大鼠模型肺组织细胞的基因和通路的变革。通过对两种常用的PH大鼠模型(MCT和SuHx)肺部细胞进行剖析,揭示了NF-κB旗子暗记通路的普遍上调和IFN旗子暗记通路的下调。SuHx模型中的非经典单核细胞和MCT模型中的传统树突状细胞特殊表现出NF-κB通路的强烈激活。与人类PH遗传位点和已知疾病基因的整合剖析评估了这些模型与人类PH的干系性。该研究在单细胞分辨率上首次揭示了两种常用PH模型中的基因和通路的独特和共享失落调情形,并证明了它们与人类PH的干系性。作者进一步深入剖析了PAECs表达模式创造了一种由Tm4sf1(在癌症中强烈表达的基因)标记的、具有独特转录组特色的内皮细胞亚群2(arterial type 2,EA2),富集了与血管天生和CXCL12旗子暗记传导有关的基因。与其他内皮细胞亚群比较,EA2处于低分解状态,从而揭示了一种可能具有干细胞或前体细胞潜能的新的Tm4sf1标记的大鼠肺内皮细胞亚群,并且证明了其对PAH的干系性[34]。此外,Rodor 等[34] 深入剖析了SuHx-PH小鼠模型的PAEC转录水平改变,并扩展了对大鼠模型和人类的比较。研究创造PH条件下PAEC的全局基因表达变革,特殊是紧张组织相容性复合体Ⅱ(the major histocompatibility complex class Ⅱ,MHC-Ⅱ)通路的上调,表明PAEC可能在PH的炎症反应中起主要浸染。该研究还识别了特定毛细血管EC群体对PH的独特反应,包括促进细胞去世亡、移动性和血管天生干系基因的上调。这些与小鼠PH发病有关的高表达基因有51%在不同物种中(人类和大鼠)也存在同步上调。通过在体外实验验证,CD74被鉴定为一个新的潜在治疗靶点。末了,研究通过轨迹剖析揭示了肺动脉至肺静脉轴线上的变革,并强调了Sgk1在动静脉过渡区的主要性。这些创造更深刻地揭示了PAECs的主要特色,是表达芯片或bulk RNA-seq所不能实现的,为开拓针对PH内皮功能障碍的治疗策略供应了新的靶点和洞见。之前的研究已经表明BMPR2、SOX17等基因突变或表达抑制是IPAH的致病成分。研究者可以把基因编辑技能运用于PH动物模型的研究,并联合单细胞测序技能,以阐明主要基因更深层次的影响。Isobe 等[35]在内皮细胞Bmpr2特异性缺失落小鼠(EC-Bmpr2-/-)的肺组织单细胞测序数据中创造,转录因子Foxf1在PAEC选择性减少,勾引DNA损伤和血管天生受损;将Foxf1分子靶向运送到再氧合EC-Bmpr2-/-小鼠的PAECs中可修复DNA损伤、勾引血管天生并逆转肺动脉高压。Yi等[36]创造内皮细胞特异性Sox17敲除(Sox17-KO)小鼠可勾引轻度自发性PH,也会加重HYP-PH。通过单细胞测序创造,PAECs中Sox17的缺失落会诱发内皮细胞功能障碍,包括细胞周期编程、增殖和抗凋亡表型的上调、对肺动脉平滑肌细胞的旁分泌效应增强、细胞连接受损以及骨形态发生蛋白(bone marrow protein,BMP)旗子暗记传导非常。经由剖析创造,这些非常可能是由于E2F1旗子暗记通路介导的,并创造对E2f1进行药理学抑制可减轻Sox17-KO小鼠PH的发展。这些研究展示了单细胞转录组与其他技能结合的上风,有助于创造新的机制并进行临床转化研究。肺动脉高压的病理机制繁芜,单细胞组学技能为从细胞层面理解其分子机制供应了新角度。当前已利用单细胞RNA测序剖析技能部分揭示了IPAH、CTEPH、高原性PH患者及PH动物模型的细胞图谱。这些研究聚焦于肺组织、肺动脉组织、某类分选的细胞或血液样品,剖析可能参与病理生理过程的新基因和通路,也揭示了不同细胞类型之间的相互浸染,为后续研究供应了线索。研究者可以通过这些研究的数据和结论,结合临床信息,进一步对PH的临床诊断和治疗产生积极的影响。只管这些数据已经向研究者展示了单细胞组学的运用前景,但PH样品获取难度较大、单细胞测序用度昂贵等方面使当前数据量仍旧很少,单个研究的科研代价仍旧有限。目前,还缺少一些针对性的单细胞测序研究,如对单个细胞亚群(如PASMC,肺血管周围成纤维细胞等)的单细胞水平研究。当前研究紧张依托于单细胞转录组,研究者仍须要连续纳入多中央、多样本、多组学剖析,结合转录组学和其他组学技能,如染色质可及性测序、代谢组学等手段,以更全面地解析这一疾病的发病机制。在数据量不断增加、完善的同时,也急迫须要对已有PH组学数据进行整合,绘制完善的、高质量的单细胞RNA或多组学图谱,进一步揭示潜在的细胞类型及其功能浸染,为治疗药物的研发供应潜在靶点。除此以外,PH动物模型与人类PH亚型的干系性是PH研究无法回避的问题。只管病理学和病理生理学研究已经部分地阐明他们的对应关系,但我们仍旧无法全面地进行评估。当前运用于PH动物模型的组学研究常日只聚焦于某种模型或组学,缺少不同PH模型之间、不同物种之间地横向比较。系统的比较PH动物模型与人类PH能够帮助研究职员精确地选择动物模型,增加根本研究向临床运用转化的能力。参考文献(略)
问答题(单选题)
1.选择得当的动物模型对付阐明该疾病的发病机制至关主要。以下哪种勾引办法构建的动物模型紧张仿照1型肺动脉高压()
A.慢性低氧联合SU5416模型
B.慢性低氧模型
C.左肺动脉结扎模型
D.主动脉弓缩窄模型
2.以下选项中不符合普通转录组学(bulk RNA-seq)和单细胞转录组学(scRNA-seq)的技能特点描述的选项是()
A.bulk RNA-seq对样品的总RNA进行测定和计数,scRNA-seq以单个细胞的RNA为工具进行测定和计数
B.对单样本单次测序实验而言,bulk RNA-seq比scRNA-seq检测到更多的基因数量和RNA计数
C.bulk RNA-seq和scRNA-seq都能结合临床信息进行剖析
D.bulk RNA-seq和scRNA-seq都能获取不同细胞类型之间的互作信息
3.以下对单细胞转录组学(scRNA-seq)技能的描述缺点的是()
A.单次实验的价格较低廉
B.单次实验可以得到成百上千的细胞转录谱信息
C.比较于单细胞微孔板建库系统,微流控建库系统捕获的基因数量更少
D.scRNA-seq可以联合其他组学进行剖析,获取更多层次的单细胞信息
4.在临床上,特发性肺动脉高压属于()肺动脉高压
A.4型
B.3型
C.1型
D.2型
5.假设研究者准备自行网络样品进行高通量测序研究,以下把稳事变缺点的是()
A.实验设计包含的多个样本尽可能同一韶光网络、同时上机测序,以避免批次效应
B.在一次高通量测序实验(或送样)中必须同时包含所有分组(实验组和对照组)
C.每网络一个样品就可以立时进行高通量实验
D.进行高通量实验的样品须要保留备份样品,并置于超低温环境储存