中国医药教诲协会肿瘤化疗专业委员会副主委/秘书长
中国医疗保健国际互换促进会肿瘤内科分会常委

中国老年肿瘤学会微生物专业委员会常委
中国中医药研究促进会肿瘤专业委员会常委
陆婧玉
北京协和医学院2021级硕士研究生
研究方向:胸部肿瘤的化疗、靶向治疗、免疫治疗
简介
靶向治疗的驱动基因突变——EGFR突变和ALK重排的创造推动了晚期非小细胞肺癌(NSCLC)患者根据生物标志物辅导选择治疗方案选。已证明多种EGFR和ALK酪氨酸激酶抑制剂(TKIs)对EGFR突变和ALK重排NSCLC患者有肯定疗效。现已研制出第三代高效TKIs——奥希替尼和劳拉替尼,只管疗效明确,TKIs耐药问题仍未办理。在运用奥希替尼或劳拉替尼治疗后疾病进展的患者中既能不雅观察到“靶向”诱发的耐药(EGFR和ALK激酶构造域发生得到性耐药突变),也存在“脱靶”所致的耐药(旁路旗子暗记通路激活或表型转变等非靶向激酶突变)。耐药机制的种类和生物学特点的深入探索为研发更有效的治疗药物供应了新的思路。在这篇综述中,我们紧张谈论了第三代EGFR和ALK抑制剂的发展进程,紧张耐药机制及目前临床应对耐药的方法及未来研究方向。
一
NSCLC中EGFR突变
1.早期EGFR TKIs
20世纪早期第一代可逆性EGFR抑制剂——吉非替尼和厄洛替尼最初治疗未筛选的晚期NSCLC患者时疗效甚微(客不雅观缓解率ORRs约10-20%,中位无进展生存期PFS约3个月),后对个别缓解者的转化研究创造在不吸烟的亚裔患者中EGFR激酶构造域存在体细胞驱动基因突变,最常见的EGFR突变是19号外显子缺失落突变或21号外显子L858R点突变,存在这两种突变的EGFR对EGFR TKIs的敏感性比野生型高100倍以上。然后在存在EGFR突变的晚期NSCLC患者中前瞻性评价吉非替尼或厄洛替尼的疗效,结果令人震荡(ORRs高达75%,中位PFS为7-12个月)。2010年开展的随机对照试验明确指出第一代EGFR TKIs无论是ORRs(75% vs <40%)还是中位PFS(8-10个月vs 4-8个月)均优于化疗,为EGFR TKIs作为EGFR突变NSCLC患者一线治疗方法奠定了根本。
只管初始疗效显著,但第一代EGFR抑制剂得到性耐药常日发生在用药后1年内。最常见的耐药机制(60%)是EGFR继发T790M突变,增强了对ATP的亲和力限定了吉非替尼和厄洛替尼的结合。为战胜EGFRT790M所致耐药研发了第二代和第三代EGFR TKIs,只管临床前试验模型结果认为第二代不可逆全ErbB抑制剂(阿法替尼、达克替尼)能够对抗EGFRT790M,但临床试验中并未不雅观察到这种征象。这可能是由于第二代EGFR TKIs抑制了野生型EGFR,导致剂量限定性皮肤和胃肠道毒性反应,无法达到抑制EGFRT790M所需的药物浓度。但这两种TKIs终极被FDA批准作为EGFR突变患者的一线治疗(OS比第一代EGFR TKIs延长8个月)。
2.奥希替尼
奥希替尼是对常见EGFR突变和T790M耐药突变均有明确疗效的选择性第三代不可逆EGFR TKI。只管奥希替尼是多种药物外转运体(渗透性糖蛋白Pgp和乳腺癌抵抗蛋白BCRP)的转运底物,但它与这些转运体的亲和力低,在脑脊液中可富集达较高浓度,CNS疗效优于早期EGFR TKIs。在第一代EGFR TKIs治疗后发生T790M得到性耐药的患者中比拟奥希替尼和化疗的疗效,奥希替尼治疗患者的ORR(71% vs 31%)和PFS(10.1 月vs 4.4月)更好,CNS转移的患者也实现了更好的PFS(8.5月vs 4.2月)。2015年奥希替尼被FDA加速批准用于治疗早期EGFR TKIs治疗后进展的EGFRT790M阳性的NSCLC患者。
随后FLAURA研究比拟了奥希替尼和吉非替尼或厄洛替尼一线治疗晚期EGFR突变NSCLC患者的疗效,结果显示奥希替尼组中位PFS更长(18.9月vs 10.2月),发生CNS进展更低(6% vs 15%),中位OS更长(38.6月vs 31.8月)。目前奥希替尼为晚期EGFR突变NSCLC患者一线标准治疗。
二
NSCLC中ALK重排
1.第一、二代ALK TKIs
临床中ALK重排常见于不吸烟的年轻腺癌患者。在ALK重排NSCLC患者中第一个评价的靶向治疗药物—克唑替尼是一种多靶点抑制剂,最初用作MET抑制剂,后创造其对ALK和ROS1激酶也有抑制浸染。Ⅰ/Ⅱ期试验证明克唑替尼对晚期ALK重排NSCLC患者有肯定疗效,ORRs为60%。2013年FDA批准克唑替尼用于治疗晚期ALK重排NSCLC患者,这解释生物标志物辅导的治疗不仅适用于EGFR突变NSCLC患者,首创了晚期NSCLC个体化精准治疗时期。后续Ⅲ期临床试验也证明克唑替尼对ALK重排NSCLC患者的疗效优于传统化疗。
和早期EGFR TKIs一样,克唑替尼得到性耐药非常常见,常在治疗后1年内涌现(中位PFS:7.7-10.9个月)。为战胜克唑替尼耐药,研发了色瑞替尼、阿来替尼、布加替尼等更高效的第二代ALK TKIs。这些第二代ALK TKIs对克唑替尼治疗后耐药患者仍旧有效且对CNS病灶疗效更好。比拟克唑替尼和第二代ALK TKIs疗效差异的Ⅲ期临床试验结果为第二代ALK TKIs取代克唑替尼成为晚期ALK重排NSCLC患者一线标准治疗奠定了根本。
2.劳拉替尼
劳拉替尼是针对早期ALK TKIs得到性耐药研发的第三代高效选择性ALK/ROS1 TKI,对多种ALK耐药突变均有疗效。ALK重排的NSCLC患者发生CNS转移概率很高(60-73%),劳拉替尼能够减弱Pgp过表达细胞药物外转运浸染,提高其在CNS的浓聚及渗透。在一项环球性Ⅱ期临床试验中,劳拉替尼对至少接管过一种ALK TKI治疗的患者依然有效,ORR为47%,颅内病灶缓解率为63%。特殊是在接管过至少一种第二代ALK TKI治疗的患者中,劳拉替尼的ORR和中位PFS分别为40%和6.9个月。值得把稳的是,劳拉替尼对第二代ALK TKIs耐药突变的肿瘤疗效更佳,提示这部分肿瘤仍旧依赖ALK旗子暗记通路生存。FDA在2018年批准劳拉替尼治疗一线阿来替尼或色瑞替尼治疗后进展或克唑替尼及另一种ALK TKI治疗后进展的晚期ALK重排NSCLC。
Ⅲ期临床试验CROWN比拟了克唑替尼和劳拉替尼一线疗效差异,结果显示劳拉替尼疗效明显优于克唑替尼,患者疾病进展和去世亡率明显降落且发生CNS转移所需韶光更长。2021年3月劳拉替尼被正式批准用于治疗初治晚期ALK重排NSCLC患者。
三
得到性耐药
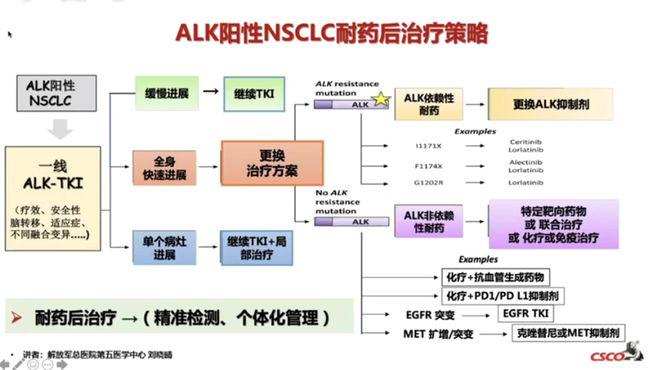
只管第三代EGFR和ALK TKIs疗效显著,但肿瘤发生得到性耐药是无法避免的,亟需更多研究深入探索耐药的种类及机制。广义上,得到性耐药可以分为“靶向”(或称靶点依赖,即靶点激酶突变,TKI存在时仍存在持续性RTK激活及旗子暗记传导)或“脱靶”两种(或称非靶点依赖,即涌现一种或多种旁路旗子暗记激活,上调下贱旗子暗记转导蛋白表达或发生表型转换)。下面将详细阐述奥希替尼和劳拉替尼得到性耐药的机制。
1.靶向耐药
(1)奥希替尼靶向耐药机制
奥希替尼能够与EGFR ATP结合处的半胱氨酸797(C797)残基形成共价键,因此C797残基是发生奥希替尼耐药的薄弱位点。事实上,二线运用奥希替尼后进展的患者中有10-26%发生了EGFRC797S突变。其它较罕见的引起奥希替尼耐药的EGFR突变发生率低于C797S,包括但不限于:G796X滋扰奥希替尼结合;影响激酶铰链区的L792X,位于p环的L718X均可产生空间位阻效应;位于p环的G724S突变可以诱发甘氨酸环构造改变而影响药物相容性。但奥希替尼发生耐药突变率明显低于早期EGFR TKIs发生T790M的突变率。第三代EGFR TKIs治疗后也存在EGFR扩增征象,但须要比拟治疗前后肿瘤组织EGFR拷贝数来确定EGFR扩增对奥西替尼耐药的浸染机制。
奥希替尼一线治疗后“靶向”耐药比后线治疗更少见。FLAURA试验结果的耐药机制剖析显示EGFRC797X突变仅见于7%患者,而在奥希替尼耐药的肿瘤组织中并未检测到EGFRT790M突变,这提示前期治疗靶点能够决定得到性TKI耐药的突变类型。
(2)劳拉替尼靶向耐药机制
约50-60%第二代ALK TKIs耐药机制为ALK激酶构造域突变,不同第二代TKI有独特的ALK耐药突变机制。例如阿来替尼治疗后最常见的耐药突变为G1202R(25-30%)和I1171X(10-15%)。劳拉替尼治疗后肿瘤进展的患者发生靶向耐药突变的频率比第二代ALK TKIs低,仅25-30%,这可能提示劳拉替尼对野生型ALK和多种单一ALK耐药突变均有疗效。事实上,劳拉替尼的靶向耐药突变为复合型ALK突变(C1156Y/L1198F、G1202R/L1196M、I1171N/D1203N等)。这些复合型ALK突变组合多变且常涉及两个或多个激酶构造域,降落了劳拉替尼的治疗活性或阻碍其结合。对发生得到性耐药的患者肿瘤组织进行全外显子测序剖析显示ALK耐药突变会在ALK TKI治疗过程中逐步累积,终极形成对大部分ALK TKIs耐药的难治性复合突变。
2021年FDA批准劳拉替尼用于一线治疗,CROWN研究的中期报告显示仅有28%的患者涌现疾病进展,这部分患者耐药的缘故原由尚不可知。但临床前研究数据显示一线劳拉替尼治疗发生靶向耐药的概率明显低于后线治疗(25-30%)。一项运用乙烷亚硝基脲诱发非突变型EML4-ALK基因形成Ba/F3细胞(仿照初治ALK重排肿瘤细胞)的研究中,长期运用劳拉替尼并未诱发形成单个ALK耐药突变。但在ALK激酶构造域存在单个突变的EML4-ALK Ba/F3细胞(仿照ALK TKI治疗后肿瘤细胞)中,劳拉替尼治疗后涌现了一系列耐药复合突变。这一结果表明ALK TKI治疗后会涌现一系列单个ALK突变而一线运用劳拉替尼能够减少耐药突变的发生。另一项研究创造一种新型单个ALK突变(L1256F)能够导致劳拉替尼耐药,可能与劳拉替尼的氟苯环构造形成空间位阻有关,但尚未在患者体内创造这种突变。Yoda等人的研究也提示:复合ALK突变更随意马虎发生在已经存在单个耐药突变的肿瘤细胞中,故一线运用劳拉替尼或许能够抑制或延迟靶向耐药的发生。
值得把稳的是,不同ALK领悟基因型可能会影响ALK抑制剂的靶向耐药。一项研究提示ALK耐药突变,特殊是ALKG120R(第二代ALK TKIs治疗后最常见的ALK突变)在EML4-ALK 3型中比1型更常见。目前无法确定不同ALK领悟基因型是否会影响劳拉替尼的得到性耐药。
2.脱靶耐药
(1)平行旁路旗子暗记转导通路
由旁路旗子暗记通路激活所致的耐药的标志性特点为:运用驱动基因和旁路旗子暗记通路双抑制剂能够战胜耐药。MET扩增是EGFR突变NSCLC中创造的第一个旁路耐药机制,可见于7-15%一线奥希替尼治疗患者和9.8-30%后线奥希替尼治疗患者之中。MET扩增是临床中另一个可以运用靶向MET抑制剂治疗的靶点。TATTON研究评价了奥希替尼联合MET TKI沃利替尼治疗第三代EGFR TKI治疗后疾病进展的发生MET共突变的EGFR突变NSCLC患者的疗效,结果显示患者耐受性可且ORR可达30%。一项剖析了207个肿瘤标本的研究显示15%第二代ALK抑制剂治疗后复发的肿瘤组织中存在MET扩增。只管ALK和MET抑制剂联用治疗的可行性好,但干系研究较少。
另一些旁路介导的耐药机制也正在研究中,包括得到性基因重排形成新的驱动基因。代表案例为奥希替尼/布加替尼治疗后发生RET重排。由得到性RET重排介导的耐药可联用EGFR和RET抑制剂(塞尔帕替尼或普拉替尼)来治疗。EGFR突变和ALK重排NSCLC患者体内还存在多种旁路旗子暗记通路激活所致的耐药。(表1和表2)
表1 EGFR突变NSCLC的旁路耐药旗子暗记通路
表2 ALK重排NSCLC的旁路耐药旗子暗记通路
只管下贱旗子暗记通路引起耐药的详细机制尚未明确,但EGFR或ALK的下贱效应旗子暗记通路能够发生再激活而导致耐药。例如RAS-MAPK通路是EGFR和ALK浸染通路中共同的关键下贱通路,它可被多种机制再激活而导致耐药(如得到性BRAF领悟、KRAS突变、NRAS突变、MAP2K1突变、DUAP6缺失落或野生型NRAS或KRAS重获)。从临床前模型数据可知ERK上调可致第三代EGFR抑制剂耐药,联合运用MEK/ERK抑制剂能够规复肿瘤细胞对EGFR TKIs的敏感性。
(3)组织学表型转变
对EGFR或ALK TKIs治疗后疾病进展的患者再次进行肿瘤组织活检是非常主要的,组织活检不仅能够进行基因检测,还可以明确肿瘤是否发生表型转变。早期EGFR 抑制剂治疗后肿瘤组织发生小细胞癌(SCLC)转化而耐药患者约为3-14%,这一征象在一线奥希替尼治疗中更常见。引起细胞表型转化的机制尚未明确。已知在转化肿瘤组织中原始EGFR突变依然存在但肿瘤增殖不再依赖EGFR旗子暗记通路,EGFR TKIs不再具有疗效。值得把稳的是,基线肿瘤组织中RB1和TP53失落活的肿瘤发生SCLC转化的概率明显升高(43倍)。一项回顾性研究显示67名发生表型转化的EGFR突变SCLC患者的总体生存预后较EGFR突变NSCLC患者差,这部分患者化疗持续缓解韶光和OS均缩短(表型转化患者中位OS为10.9个月)。腺癌也可以发生鳞癌转化,一项包含62名奥希替尼一线治疗后疾病进展的患者的研究中有5人发生了鳞癌转化。这种表型转换也是预后不良的预测成分之一。ALK TKIs治疗后也会发生向小细胞癌或鳞癌转化的情形。一项评估了168名对第二代ALK TKIs耐药的ALK重排NSCLC患者的研究结果显示,有1.2%的患者发生了小细胞癌转化,比EGFR突变NSCLC患者比例低。不同分子亚型的NSCLC细胞的可塑性和组织表型转化的差异尚未明确。第二代TKIs耐药后及时进行二次组织活检是非常必要的,临床年夜夫须要根据不同的转化表型选择不同的治疗。目前无法通过液体细胞活检检测肿瘤细胞表型转化。
在EGFR突变和ALK重排的患者中也可以见到上皮-间质转化(EMT),EMT可能与肿瘤侵袭性干系。EMT是一种守旧的进展办法,上皮细胞逐渐失落去细胞连接和极性,发生迁移和浸润。EMT在多种抗肿瘤治疗中都能导致原发性或得到性耐药。EMT转录调节子已被作为肺腺癌患者的治疗靶点。近年来有研究显示EMT与奥希替尼和劳拉替尼治疗耐药有关。临床前研究显示EMT介导的奥希替尼耐药会发生ATR-CHK1-auroraB旗子暗记通路激活,联用EGFR和auroraB激酶抑制剂能战胜这种耐药征象。
(4)原发性耐药
所有运用EGFR和ALK TKIs治疗的EGFR 突变和ALK重排的肺癌临床试验中,原发肿瘤进展(对初始治疗无反应)的患者占初诊患者的4-10%,这部分患者对TKIs治疗无反应,属于原发性耐药。原发性耐药的机制是近期研究的热门领域,可能的机制有:已发生非TKI敏感性突变(如EGFR 20外显子插入突变对早期EGFR TKI治疗无反应);其他旗子暗记通路共突变(NF-kB)或生殖细胞中编码BCL-2样蛋白11的基因缺失落(BIM)。理论上,所有TKI难治性靶向或脱靶突变都能导致相应TKI原发性耐药。下一代测序能够确定基线是否存在靶向基因共突变,从而明确肿瘤生物学特性。
3.战胜耐药的疗法
(1)重视寡进展
惰性或无症状疾病进展的患者,如果证明确有临床获益可连续沿用原方案治疗。如涌现寡进展的患者体内多个散在病灶掌握良好而只涌现一个或多个小转移灶时,联合局部溶解治疗疗效较好。值得把稳的是,多个小型行列步队研究显示全身立体定向放疗能有效掌握多个散在局部进展病灶,在驱动基因阳性的NSCLCs患者中实现PFS获益。
(2)重视颅内进展
接管有CNS活性的EGFR或ALK TKIs治疗后发生CNS寡进展时,可以进行立体定向放疗或手术切除。而多灶性CNS进展则须要换用其他治疗手段,如加用培美曲塞化疗(培美曲塞对发生脑转移的肺腺癌患者有CNS疗效),进行全脑放疗、换用血脑樊篱透过性更强TKI或提高选择性TKIs的剂量来增加其CNS浓度。一项Ⅱ期临床试验小样本量亚组剖析将发生CNS进展的EGFR突变NSCLC患者的奥希替尼治疗剂量从每天80mg增加到每天160mg来评价患者的疗效,个中54%标准剂量奥希替尼治疗后发生单个颅内进展的患者的颅内病灶经大剂量奥希替尼治疗后实现缓解,只管持续缓解韶光较短(中位颅内PFS为3.8-7.0个月)。这与另一项多中央回顾性研究结果同等,该研究认为提高奥希替尼治疗剂量对发生CNS进展的患者而言疗效有限。在另一项Ⅱ期研究中EGFRT790M阳性NSCLC患者(运用早期EGFR抑制剂治疗后疾病进展)接管160mg奥希替尼治疗后,存在脑转移且进行过T790M靶向治疗患者ORR可达50%。相反,将劳拉替尼剂量增加至>100mg/天并不能改进发生CNS转移的ALK重排NSCLC患者的疗效。比较之下,有研究证明提高第二代ALK TKIs(阿来替尼、布加替尼)治疗剂量能够成功实现CNS病灶勾引再缓解。
(3)重视全身进展
涌现全身进展的患者须要改换系统治疗方案。可选择的方案较多,如换用其他类型TKI(战胜靶向耐药)或联合其他治疗(战胜脱靶耐药)。
新型后代TKIs
为战胜第三代TKIs靶向耐药,多种第四代EGFR和ALK TKIs正在研发中。EAI045是一种通过C螺旋结合在非激酶活性构造域的变构EGFR抑制剂。体外试验证明EAI045单药能抑制EGFR L858R和T790M突变,但体内试验并未不雅观察到上述疗效。在小鼠模型中,当与西妥昔单抗联用时,EAI045能够抑制L858R-T790M驱动和L858R-T790M-C797S驱动的肺癌。但西妥昔单抗抑制野生型EGFR的不良反应限定告终合治疗的实际临床运用代价。JBJ-04-125-02是另一种正在研发的变构EGFR抑制剂,能在体内外抑制L858R-T790M-C797S型EGFR的浸染。JBJ-04-125-02与奥希替尼联用可能疗效更好。BLU-945和BLU-701也是高效可透过CNS且不与野生型EGFR结合的第四代EGFR TKIs。在临床前研究中,BLU-945能抑制三联EGFR突变亚型(EGFR L858R突变、19外显子缺失落、T790M和C797S),而BLU-701可能浸染于一线奥希替尼治疗后耐药的无T790M突变患者的关键治疗靶点。BLU-945和BLU-701都正在进行早期临床试验。
为战胜劳拉替尼耐药的复合型ALK突变,新型ALK TKIs正在研发中。TPX-0131是一种含有致密大环构造的下一代ALK TKI,它能和ALK激酶ATP结合位点的袋状构造紧密结合,纵然是突变受体也能较好的抑制ALK激酶活性。在异种移植物模型中TPX-0131比目前已批准上市的ALK TKIs对野生型ALK和多种单发或复合ALK突变疗效更好。该药正在进行Ⅰ期临床试验。NVL-655是一种选择性CNS透过性强的下一代ALK TKI,它对多种劳拉替尼复合耐药突变(G1202R-L1196M、G1202R-L1198F和G1202R-G1269A)均有活性,该药有望在2022年开展Ⅰ期临床试验。一项针对ALK重排细胞系和体外异种移植物的剖析研究显示,某些特定的劳拉替尼类似物能够更高效的抑制G1202R型复合ALK突变,对I1171N/S/T型复合突变疗效较差。TPX-0131对ALK G1202R和G1202R型复合突变的疗效较I1171型突变更好。对发生得到性复合耐药突变的患者下一步靶向治疗方案选择方面还有许多值得研究地方。
TKIs再寻衅
除研发新型TKIs外,老一代TKIs或广谱激酶抑制剂“再寻衅”战胜第三代EGFR或ALK TKIs靶向耐药的研究也正在进行中。有临床前研究及病例宣布称布加替尼(一种在临床前研究中证明对ROS1、FLT3和EGFR均有浸染的ALK TKI)联合西妥昔单抗能够抑制EGFR三联突变从而战胜奥希替尼耐药。某些ALK重排NSCLC患者发生劳拉替尼耐药突变后能规复对早期ALK TIKs的敏感性。例如,一名因发生ALK C1156Y突变而对克唑替尼耐药进展的患者在换用劳拉替尼后发生了ALK C1156Y-L1198F复合突变而对劳拉替尼耐药,在细胞株模型中这种复合突变规复了对克唑替尼的敏感性,终极这名患者又换回克唑替尼连续治疗。
四
联合治疗
联合治疗是一种能延缓或战胜第三代抑制剂耐药的替代疗法。以下所有联合疗法都还在研究中。
第一种联合疗法是联用针对同一RTK靶点的早期和第三代TKI。Niederst等人研究证明,当EGFR T790M和C797S同时发生在一对等位基因上时,联用第一代和第三代 EGFR TKI能重新抑制EGFR。有病例宣布显示双联EGFR TKI治疗至少能实现短期生存获益,也有可能实现长期生存获益。一项Ⅱ期多臂ORCHARD试验(NCT03944772)正在评估一线奥希替尼治疗后发生C797X突变的患者奥希替尼联合吉非替尼的疗效。其他临床试验正在评估第三代和早期EGFR TKI联用治疗初治EGFR突变NSCLC患者的疗效,明确联合治疗能否延迟耐药的发生。在ALK重排NSCLC患者中,一项在澳大利亚两个医学中央开展的临床试验正在评价调度克唑替尼和劳拉替尼的治疗顺序能否延迟耐药发生。
第二种联合疗法是将EGFR或ALK TKI和另一种靶向治疗抑制剂联用来抑制脱靶耐药。支持这种联合疗法的循证依据正在积累中。前文提到的ORCHARD试验在生物标志物选择性患者亚组中评价了奥希替尼联合多种非EGFR靶向治疗的疗效和安全性差异。还有许多正在操持和进行的研究在EGFR突变的NSCLC患者中验证奥希替尼为主的多种联合治疗的疗效。同样在ALK重排NSCLC患者中,劳拉替尼联合其他靶向药物,如MET抑制剂或SHP2抑制剂的疗效都正在研究中。
第三种联合疗法是一种EGFR或ALK TKI联合化疗。对早期运用第三代EGFR或ALK TKIs治疗后疾病进展的患者,化疗紧张浸染于TKI耐药的肿瘤细胞,同时连续运用TKI担保其CNS疗效。治疗EGFR突变的NSCLC患者的履历显示奥希替尼单药治疗后疾病进展的患者加用化疗后并不会增加不可耐受的不良反应并可能延长PFS。Ⅲ期COMPEL随机对照试验的研究目的是明确奥希替尼联合培美曲塞+铂类化疗治疗奥希替尼一线治疗后颅外肿瘤进展患者的疗效。这种联合疗法在ALK重排NSCLC患者中尚未进行大型前瞻性研究,但从一项小型回顾性研究结果中可以看出第二代ALK TKI治疗后进展的患者在ALK TKI治疗根本上加用化疗能够延长PFS。另一个问题是同时运用TKIs和化疗和序贯运用TKIs和化疗是否会导致患者PFS和OS的差异。理论上,前期利用最大耐受剂量的细胞毒性治疗可能会减少乃至打消TKIs耐药细胞亚群,从而降落肿瘤复发风险。在EGFR突变NSCLC患者中进行的两项独立随机对照试验结果显示一线吉非替尼联合化疗能够显著延长患者的FPS(8-10个月)和OS(12个月) 。Ⅲ期FLAURA 2试验正在评估在初治EGFR 突变非鳞非小细胞肺癌患者中一线奥希替尼联合化疗的疗效与奥希替尼单药疗效的差异。
末了一种联合疗法是将EGFR 或ALK TKIs和抗血管天生药物联用。抗血管天生药物,如贝伐珠单抗(一种抗VEGFR单抗),能改变肿瘤组织的血管构造,从而影响药物转运和疗效,抑制肿瘤成长。临床前研究证明EGFR或ALK TKIs与抗血管天生药物联用具有协同效应。初治EGFR突变NSCLC患者Ⅱ期或Ⅲ期研究证明厄洛替尼联合雷莫芦单抗或贝伐珠单抗治疗的患者FPS明显延长,但OS未见显著获益。另有一项随机研究比拟了后线奥希替尼联合贝伐珠单抗与奥希替尼单药治疗EGFR突变NSCLC患者疗效,并未不雅观察到联合治疗组PFS和OS获益。日本一项小行列步队研究中也未创造奥希替尼联合贝伐珠单抗能够改进患者PFS。另有一项Ⅲ期研究正在评价一线奥希替尼联合贝伐珠单抗比拟奥希替尼单药治疗晚期EGFR突变NSCLC患者的疗效差异。ALK重排患者中TKIs联合抗血管天生药物的疗效也正在探索中,Ⅰ/Ⅱ期小样本量研究显示阿来替尼联合贝伐珠单抗疗效可且患者耐受良好。
五
免疫治疗
考虑到患者的用药风险,目前不推举ICIs和EGFR或ALK TKIs联用。正在等待基因检测结果的初诊患者应避免过早运用ICIs以防后续换用TKI诱发不良反应。
六
新型疗法和未来研究方向
细胞毒性药物-抗体偶联制剂(ADCs)和双特异性抗体是正在研发的对TKI耐药肿瘤患者可能有效的新型疗法。这类药物因具有战胜多种耐药机制的潜力而备受关注。埃万妥单抗是一种靶向EGFR和MET双靶点的特异性抗体,2021年5月依据CHRYSALIS试验数据获批用于治疗EGFR 20号外显子插入突变的NSCLC患者。在一项入组了45名未接管过化疗的奥希替尼耐药的EGFR19号外显子缺失落突变或L858R点突变的NSCLC患者中联用埃万妥单抗和拉泽替尼(一种第三代EGFR TKI)得到了初步疗效,ORR为36%,中位PFS为4.9个月。这种联合疗法在EGFR或MET生物标志物阳性的患者中ORR更高(47%),但阴性患者也有一定疗效(ORR=29%)。Patritumab deruxtecan是一种携带拓扑异构酶I抑制剂的HER3靶向ADC,它对至少运用过一种EGFR TKI后疾病进展的患者有效。一项剖析了48对治疗前和治疗后肿瘤标本的研究显示发生得到性耐药的EGFR突变肿瘤中HER3表达上调常见,且EGFR抑制剂能够增强patritumab deruxtecan对体外肿瘤移植物的抗肿瘤浸染。靶向TROP2和MET的ADCs对肺癌患者的疗效也正在研究中。
其他新型疗法如肿瘤疫苗可能对EGFR或ALK驱动基因突变的NSCLC患者有效。多项研究数据证明ALK是ALK阳性间变大细胞淋巴瘤的一种抗原。一种DNA ALK瘤苗被证明能在ALK驱动淋巴瘤和NSCLC小鼠模型中勾引产生较强的免疫反应,为连续研发抗ALK瘤苗供应了理论支持。精准新抗原瘤苗正在进行临床前试验进行检测,瘤苗是否能成为EGFR或ALK突变的NSCLC患者可行的治疗方案仍在探索中。
主编评语
驱动基因EGFR突变和ALK重排的创造为NSCLC治疗首创了新纪元。随后一系列强效且具有CNS活性的EGFR和ALK TKIs的研发及对EGFR和ALK TKIs耐药机制逐步深入的研究为其他NSCLC基因亚型靶向治疗研究供应了思路。只管研究不断进展,晚期EGFR突变和ALK重排NSCLC患者仍无法实现完备治愈。TKI耐药仍旧是一项未办理的寻衅。目前仍亟需新的疗法来改进这部分耐药患者的预后。基于对TKI耐药生物学机制更深入的认识和理解,我们正在进行多种联合试验、转化研究和临床研究努力探索新型疗法。
1.聚焦前沿进展,肿瘤大咖云集 ——2022 BOC/BOA大会圆满收官
2.路红教授:影像学在乳腺肿瘤整形外科领域的运用
3.郭其森教授组稿|管燕教授:晚期NSCLC靶向治疗新进展
版权声明
本文版权归医悦汇所有。欢迎转发分享,其他任何媒体如需转载或引用本网版权所有内容,须得到授权,且在能干位置处注明“转自:医悦汇”。












